
Kaslardan karaciğere amino grubunun taşınması alanin ile gerçekleştirilir.
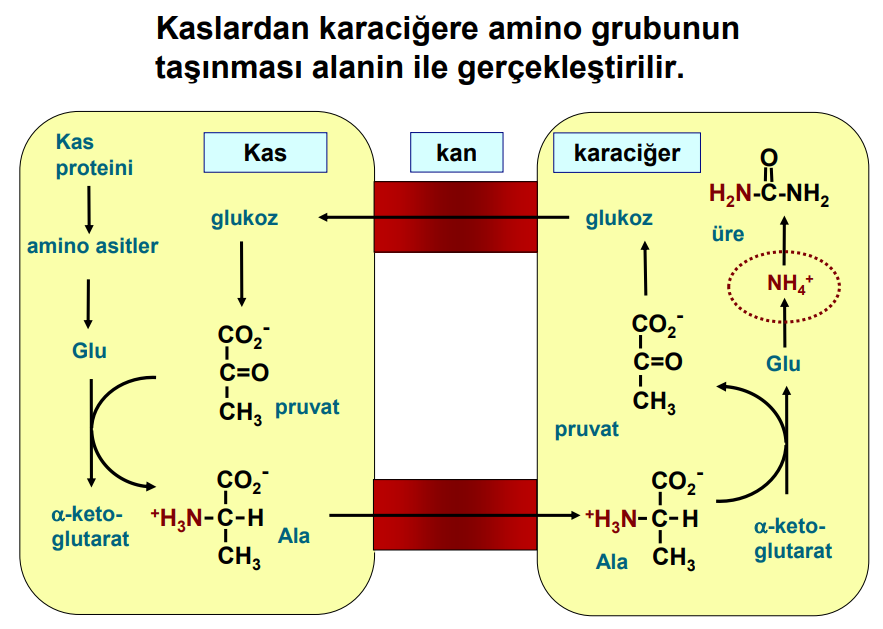
Kaslardan – Alanin (Cahill döngüsü yoluyla)
Ağırlıklı olarak açlık sırasında ortaya çıkan amino asitlerin kastan karaciğere sürekli bir taşınması vardır.
Alanin, taşınan amino asitler arasında baskındır.
İskelet kasındaki pirüvat, alanin üretmek için transaminasyona uğrar.
Alanin karaciğere taşınır ve glukoneogenez için kullanılır.
Bu döngüye glikoz-alanin döngüsü denir.
Glikoz-alanin döngüsü, iskelet kası ile karaciğer arasında değil, diğer hücreleri ve lenfoid organlar gibi bağışıklık sistemi hücreleri de dahil olmak üzere ekstrahepatik dokuları içerir.
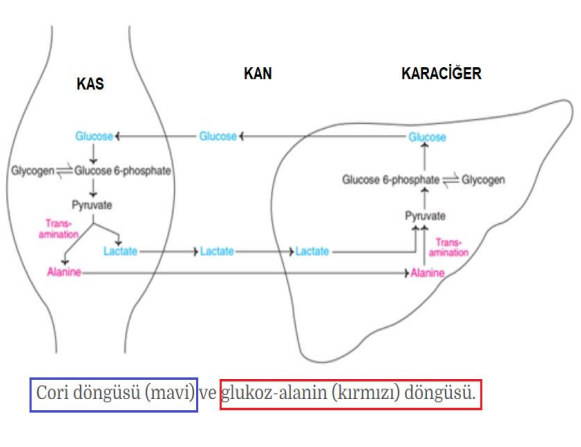
Cahill döngüsü , alanin döngüsü veya glikoz-alanin döngüsü olarak da bilinir , kaslardan gelen amino gruplarının ve karbonların karaciğere taşındığı bir dizi reaksiyondur. İskelet kası ile karaciğer arasındaki besin döngüsünde Cori döngüsüne oldukça benzerdir . Kaslar enerji ihtiyaçları için amino asitleri parçaladığında, ortaya çıkan azot alanin oluşturmak üzere pirüvata transamine edilir . Bu, L- glutamat ve pirüvatı α-ketoglutarat ve L-alanine dönüştüren alanin transaminaz (ALT) enzimi tarafından gerçekleştirilir . Ortaya çıkan L-alanin, azotun üre döngüsüne girdiği ve pirüvatın glikoz yapmak için kullanıldığı karaciğere taşınır .
Cahill döngüsü, laktat kullanan Cori döngüsünden daha az üretkendir, çünkü alaninden enerji üretiminin bir yan ürünü üre üretimidir . Ürenin uzaklaştırılması enerjiye bağlıdır, dört “yüksek enerjili” fosfat bağı (3 ATP’nin 2 ADP’ye hidrolize edilmesi ve bir AMP ) gerektirir, bu nedenle üretilen net ATP, Cori döngüsünde bulunandan daha azdır. Ancak, Cori döngüsünden farklı olarak, NADH korunur çünkü laktat oluşmaz. Bu, elektron taşıma zinciri yoluyla oksitlenmesine olanak tanır . Yapılan çalışmalar, Cahill döngüsünün karaciğerle ilişkili hastalıklar ve kanserler için yeni tedavilerin geliştirilmesinde klinik açıdan önemli olduğunu göstermiştir.
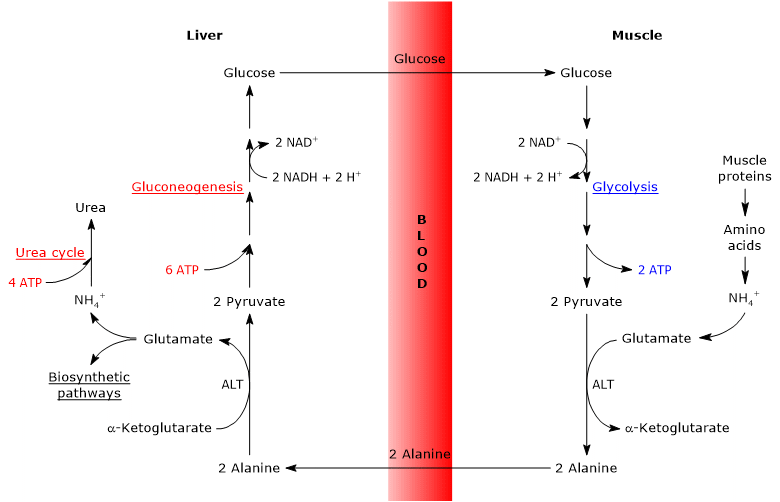
İskelet kası, dallı zincirli amino asitlerin parçalanmasıyla oluşan amonyum iyonlarını güvenli bir şekilde atmak için üre döngüsünü kullanamadığından, bundan farklı bir şekilde kurtulmak zorundadır. Bunu yapmak için amonyum, hücrede bir transaminasyon reaksiyonu yoluyla serbest α-ketoglutarat ile birleşerek glutamat ve α-keto asit üretir. Glutamik-pirüvik transaminaz (GPT) olarak da bilinen alanin aminotransaminaz (ALT), daha sonra glutamatı tekrar α-ketoglutarat haline getirir, bu sefer amonyumu glikolizden kaynaklanan pirüvata aktararak serbest alanin oluşturur. Alanin amino asidi bir mekik görevi görür – hücreyi terk eder, kan dolaşımına girer ve karaciğerdeki hepatositlere gider, burada esasen tüm bu süreç tersine döner. Alanin, serbest α-ketoglutarat ile bir transaminasyon reaksiyonuna girerek glutamat üretir, daha sonra bu glutamat deamine edilerek pirüvat ve nihayetinde serbest amonyum iyonu oluşturur. Hepatositler, üre döngüsü ile toksik amonyumu metabolize edebilir ve böylece güvenli bir şekilde atabilirler. Kas hücrelerini amonyum iyonundan başarıyla kurtardıktan sonra, döngü daha sonra enerjiden yoksun iskelet kası hücrelerine glikoz sağlar. Hepatositlerde glutamatın deaminasyonundan oluşan pirüvat, glikoz oluşturmak için glukoneogeneze uğrar ve bu daha sonra kan dolaşımına girebilir ve iskelet kası dokusuna taşınabilir ve böylece ona ihtiyaç duyduğu enerji kaynağını sağlayabilir.
Cahill döngüsü, kas , karaciğer ve bağırsak gibi dokularla sınırlı olan alanin aminotransferazın (alanin transaminaz, ALT) varlığını gerektirir . Bu nedenle, bu yol yalnızca bir aminotransferaz mevcut olduğunda, amonyağı karaciğere aktarma ihtiyacı olduğunda ve vücut katabolizma (kas yıkımı) durumunda olduğunda Cori döngüsü yerine kullanılır.
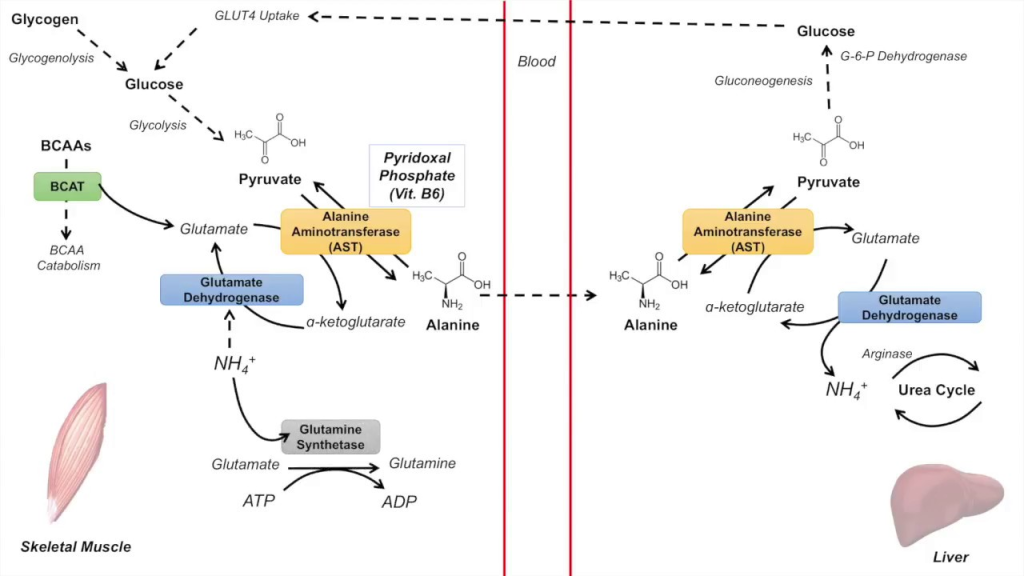
Cahill döngüsü, nihayetinde kas dokusunu toksik amonyum iyonundan arındırma yöntemi olarak hizmet eder ve ayrıca enerjiden yoksun kas dokusuna dolaylı olarak glikoz sağlar. Uzun süreli açlıklarda, iskelet kası glikojenin parçalanmasıyla üretilen glikozu desteklemek için bir enerji kaynağı olarak kullanılmak üzere parçalanabilir. Dallı zincirli amino asitlerin parçalanması, enerji amaçlı kullanılan bir karbon iskeletinin yanı sıra serbest amonyum iyonları üretir. Ancak, memeli olmayan kara omurgalılarındaki varlığı ve fizyolojik önemi belirsizdir. Örneğin, bazı balıklar alanini azot taşıyıcısı olarak kullansa da, daha yavaş bir glikoz devir hızı ve egzersiz yapan kas dokusundan daha düşük alanin salınımı nedeniyle döngünün gerçekleşmesi olası değildir
Alanin döngüsü ayrıca iskelet kasındaki ve karaciğerdeki karbon iskeletlerinin geri dönüşümü ve amonyumun karaciğere taşınmasına ve üreye dönüştürülmesine katılım gibi diğer amaçlara da hizmet eder.
Çalışmalar, glikoz-alanin döngüsünün özellikle uzun süreli açlık dönemlerinde hepatik (karaciğer) mitokondriyal oksidasyonun düzenlenmesinde doğrudan bir rol oynayabileceğini göstermiştir. Hepatik mitokondriyal oksidasyon , ATP üretimi için Sitrik Asit Döngüsü ve oksidatif fosforilasyonu içeren glikoz ve yağ asitlerinin metabolizmasında önemli bir süreçtir . Alkol Olmayan Yağlı Karaciğer Hastalığı (NAFLD), Alkol Olmayan Steatohepatit (NASH) ve Tip 2 Diyabet gibi hastalıkları aracılık etme işlevi nedeniyle hepatik mitokondriyal oksidasyonu etkileyen faktörlerin anlaşılması büyük ilgi görmektedir . Günümüzde aktif bir araştırma alanı, bu tür hastalıklar için hem hedefli hem de hedefsiz tedaviler geliştirme amacıyla hepatik mitokondriyal oksidasyonun düzenleyici rolünden yararlanmaya çalışmaktadır. Glikoz-alanin döngüsü bu önemli faktörlerden biri olabilir. Hem kemirgenler hem de insanlar üzerinde yapılan bir çalışma, 60 saatlik açlık süresince azalan alanin dönüşümünün, 12 saatlik bir gecelik açlık geçiren deneklere kıyasla hepatik mitokondriyal oksidasyonda belirgin bir azalma ile ilişkili olduğunu göstermiştir. Oksidatif aktivite oranı, öncelikle mitokondriyal oksidasyon sürecinde kritik bir enzim olan Sitrat Sentaz akışı (VCS ) oranlarının izlenmesiyle ölçülmüştür. Glikoz-alanin döngüsünün gözlemlenen etki ile nedensel bir ilişkisi olup olmadığını doğrulamak için, aynı açlık koşullarına tabi tutulan ikincil bir hasta grubuna daha sonra bir doz L-alanin enjekte edilmiştir. İnfüzyondan sonra, 60 saat aç kalan hastalarda hepatik mitokondriyal oksidasyonda belirgin bir artış görülmüş ve bu da ilişkiyi doğrulamıştır.
Glikoz-alanin döngüsü onkolojik (kanser) patogenezinde de önemli klinik öneme sahip olabilir. 2020 tarihli bir çalışma, Hepatosit Kanseri’nin (HCC) metabolik yeniden programlanmasında glikoz-alanin döngüsünün rolünü araştırdı. HCC, karaciğer kanserinin en yaygın şeklidir ve dünya çapında kanserle ilişkili ölümlerin üçüncü en yaygın nedenidir. Alternatif tedavi seçenekleri arayışı, mevcut terapötiklerin (cerrahi, radyoterapi, kemoterapi) genellikle HCC’de ciddi yan etkilere ve/veya düşük başarı oranlarına sahip olması nedeniyle kazançlı bir araştırma alanı olmaya devam etmektedir. Birçok yeni alternatif ve/veya tamamlayıcı tedavinin ortak bir özelliği, hızlı büyüme ve çoğalmayı destekleyen genel hipermetabolik durumları nedeniyle kanser hücrelerinin hücresel metabolizmasını hedeflemesidir. Sağlıklı hücrelere göre çok daha hızlı bir oranda glikoz tüketmekle birlikte, kanser hücreleri doymak bilmez beslenme ihtiyaçlarını karşılamak için büyük ölçüde amino asit metabolizmasına güvenir. Bu çalışmaya katılan araştırmacılar, glikoz-alanin döngüsü yoluyla işlenen ekzojen alaninin, besin eksikliği olan bir ortamda HCC hücreleri için alternatif enerji kaynaklarından biri olabileceğini ve bu bağımlılığın hedefli terapi için kullanılabileceğini ileri sürmüşlerdir. Bunu deneysel olarak göstermek için, HCC hücreleri besin eksikliği olan bir ortamda in vitro kültüre edilmiş ve daha sonra alanin ile beslenmiştir. Alanin desteği, bu koşullar altında HCC hücre büyümesini teşvik etmek için yeterli olmuştur – metabolik yeniden programlama adı verilen bir olgu. Daha sonra, bir dizi aşırı ifade ve fonksiyon kaybı deneyi gerçekleştirmişler ve özellikle Glutamik Pirüvat Transaminaz 1’in (GPT1), HCC hücrelerinde alanin dönüşümünde öncelikli olarak yer alan GPT izomeri olduğunu belirlemişlerdir; bu, GPT1’in karaciğerde bulunma eğiliminde olduğu yönündeki önceki bulgularla tutarlıdır. Metabolik olarak yeniden programlanmış HCC hücrelerini, GPT1’in doğal olarak oluşan bir inhibitörü olan Berberin ile tedavi ederek devam etmişlerdir; gözlemlenen etki, ATP üretimini ve dolayısıyla alaninle beslenen kanser hücrelerinin büyümesini sınırlamaktı. Çalışmaları, glikoz-alanin döngüsünün bileşenlerinin, özellikle GPT1’in, alternatif HCC terapileri için bir hedef olarak iyi bir seçim olabileceğini ve bitki kaynaklı seçici bir GPT1 inhibitörü olan Berberinin, bu yeni ilaçlardan birinde kullanım potansiyeline sahip olduğunu gösterdi. Alaninin kanser hücreleri için alternatif bir yakıt olarak kavramı, pankreas kanseri hücreleri üzerinde gerçekleştirilen diğer çalışmalarda da benzer şekilde gösterilmiştir.