
Refeeding (yeniden beslenme) sendromu, uzun süren açlık veya yetersiz beslenmenin ardından başlayan yeniden beslenme sonucunda, elektrolit ve metabolik bozuklukların eşlik ettiği, hayatı tehdit eden, ciddi bir sendromdur. Patofizyolojisi iyi biliniyor olmasına rağmen hangi koşullarda oluştuğu, kliniğe yansıma biçimleri ve her hastaya yaklaşım farklılık göstermektedir. Refeeding sendromu, ilk olarak İkinci Dünya Savaşı sırasında, savaş esirlerinin beslenmeye başlamasının ardından beklenmedik hastalıklar ve ölümler yaşamaları sonucunda fark edilmiştir. Son yıllarda yapılan çalışmalarda refeeding sendromu insidansı %18-28 arasında değişmektedir. Malnütrisyon, kanser, nörolojik hastalıklar, yaşlı hastalar, cerrahi nedenler, solunum yolları hastalıkları, gastrointestinal ve karaciğer hastalıkları, insan immün yetmezlik virüsü/kazanılmış immün yetmezlik sendromu (HIV/AIDS) ve böbrek hastalıkları dahil birçok farklı hastalık grubunda görülebilir. Malnütrisyon sonrası hastanın yüksek miktarda beslenmesi ile elektrolit bozuklukları (özellikle hipofosfatemi, hipokalemi ve hipomagnezemi), vitamin düzeylerinde azalma [özellikle B1 vitamini (tiamin)], sıvı dengesizliği ve tuz tutulumu meydana gelebilir. Bunlar ise kardiyak, nörolojik yan etkiler ve bozulmuş organ fonksiyonları ile giden hatta ölümle sonuçlanabilen bir tablo ile karşımıza çıkabilir. Hipofosfatemi, sıklıkla bu sendromun ayırt edici özelliği olarak kabul edilir.
Refeeding sendromu, parenteral yolla yeniden beslenmeye göre (%17.5), enteral yolla yeniden beslenmede (%37.5) daha sık bildirilmiştir
Patofizyoloji
Uzun süreli beslenme yoksunluğu ile sağkalım, mevcut enerji rezervlerinin etkin bir şekilde kullanımına ve koruma yeteneğine bağlıdır. Açlık derinleştikçe, enerji depolarının yanı sıra vitaminler ve hücre içi elektrolitler de tükenir. Elektrolitlerin dengesinin bozulması, ishal, bağırsak içeriğinin kaybı (örn. fistül, kusma, gastrik drenaj) veya diüretik kullanımı gibi ek kayıplarla daha da şiddetlenebilir.
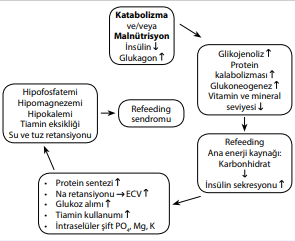
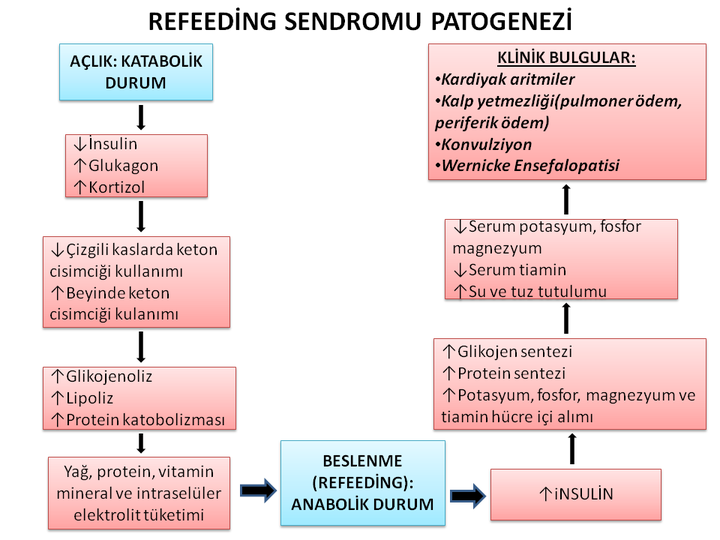
Katabolik durumların adaptasyon aşaması sırasında, metabolik süreçler normalin %30-50’sine indirilir. Hasta katabolik bir durumdayken (azalmış gıda alımı ve açlık nedeniyle), insülin üretimi azalırken, glukagon ve katekolamin üretimi uyarılır. Açlık sırasında glukoz oksidasyonu azalır ve sadece beyin, renal medulla ve kırmızı kan hücreleri gibi glukoza bağımlı dokularda oksidasyon gerçekleşir. Glikojen depoları yetersiz kalınca, glukoneogenez aktive olur ve artmış proteoliz ile salınan endojen amino asitlerden glukoz üretimi başlar. Böylece, kas kütlesinde azalma, fonksiyonel zayıflık ve kilo kaybı meydana gelir. Birkaç gün sonra ise lipoliz artar ve ardından dolaşımda serbest yağ asitleri yükselir. Kandaki serbest yağ asitleri karaciğerde ketogenezi uyarır ve vücut için ana enerji kaynağı haline gelen keton üretimine (özellikle asetoasetat ve beta-hidroksibütirat) yol açar.
Kan dolaşımında glukoz seviyesi yükseldiğinde ise yanıt olarak insülin salgısı artar.[8-10] Artan insülin seviyesi hem direkt etkiyle (sodyum-potasyum ATPaz’ın stimülasyonu ile) hem de ihtiyaç nedeniyle (glukozun fosforilasyonu) fosfor ve potasyumu hücre içine yönlendirerek elektrolit düzeylerinde azalma görülür
Bu süreçten etkilenen diğer bir elektrolit olan magnezyum düzeyindeki azalmanın mekanizması net olarak aydınlatılamamıştır. Serum elektrolitlerindeki azalma ani, şiddetli hatta katabolik bir hasta için ölümcül bile olabilir.
Fosfat hem enerji üretimi hem de hücreye transport işlemleri için önemli bir elektrolittir. İnsanlarda enerjinin ana depolama formu olan adenozin trifosfat (ATP)’ın önemli bir bileşenidir. Fosforun tükenmesi aynı zamanda 2,3-difosfogliserat üretimini azaltır ve bu hemoglobinde oksijen afinitesinin artışına, dokulara oksijen salınımının azalmasına ve doku hipoksisine neden olur. Glikoliz, sadece fosforile glukoz gerektirdiğinden, fosfat besleme fazında özellikle önemlidir. Hipofosfatemi, rabdomiyoliz, hemoliz, solunum yetmezliği, kas-iskelet bozuklukları ve kardiyak kontraktilitede azalma gibi çeşitli klinik belirtilere neden olabilir. Şiddetli hipofosfatemi (Malignitesi olan hastalar uzun süreli açlık ve/veya elektrolit kayıpları nedeniyle refeeding sendromu için risk altındadırlar. Hastalığın kendisi ve tedavilere bağlı yan etkiler yeniden beslenme sendromu oluşma riskini tetikleyebilir. Besin emilimini etkileyen, altta yatan hastalıklar ve koşullar da (örn. kısa bağırsak sendromu, bariyatrik cerrahi, yeme bozuklukları) risk faktörleri arasında olabilir.
Crohn hastalığı nedeniyle uzun süredir yeterli beslenemeyen hastaya obstrüksiyon nedeniyleacil ameliyat yapılması gerekiyor. Ameliyattan sonra Hastaya beslenme desteği için atak öncesi kilosuna göre hesaplanan Kalori-Protein hesabı ile Enteral Nutrisyon başlanıyor. Takibinde kan şekeri regülasyonu bozulan hastada ayrıca hipofosfatemi, hipomagnezemi ve hipokalemi gelişiyor.
Buna göre durumu açıklayacak en olası sebep aşağıdakilerden hangisidir?
A) Obstruksiyon devam ediyor olabilir
B) Hastaya aynı kalori hesabı ile TPN verilmelidr
C) Reefeding Sendromu gelişmiş olabilir ********
D) Protein desteği yetersiz kalmış olabilir
E) Su intoksikasyonu gelişmiştir
REFEEDİNG SENDROMU
Refeeding sendromu (rFs), ağır malnutrisyonlu kişilerde aşırı ve hızlı gıda alımı sonucunda ortaya çıkan bir seri metabolik ve biyokimyasal değişimin tehlikeli bir sonucu olarak bilinir. Enteral beslenme ile daha fazla olduğu rapor edilmiştir. Beslenmeye başlanılan ilk birkaç günde belirginleşme eğilimindedir. Yaşlılarda daha yaygındır ve altta yatan başka hastalıkların eşlik ediyor olması nedeniyle mortalite için ciddi bir risk oluşturur.
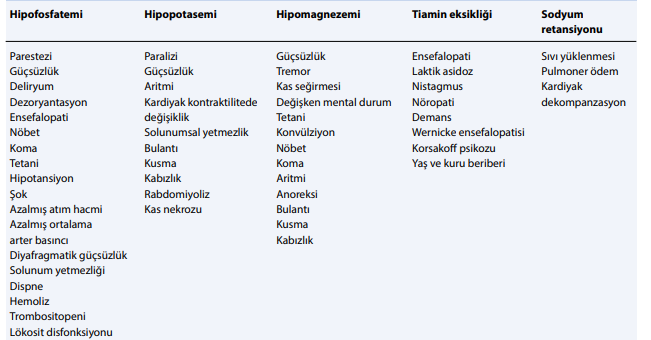
Refeeding sendromunun öncelikli özelliklerinden biri hipofosfatemidir. Refeeding sendromunda görülen bir diğer laboratuar bulgusu hipomagnezemidir. Bir diğer beklenen elektrolit düzensizliği hipokalemidir. Refeeding sendromunda anormal glukoz ve lipid metabolizması da devrededir. Glukoz alımı ile düşük negatif nitrojen balansına ve aminoasitlerin kullanımında azalmaya yol açarak glikoneogenezis baskılanır.
16 yaşında kız çocuğu kilo kaybı, istemli kusma ve senkop şikayetleri ile getiriliyor. Vücut kitle indeksi 15 kg/m² saptanan hastaya nazogastrik tüp aracılığıyla nutrisyon başlanıyor. Hastanın izleminde başvurusunun 36. saatinde nefes darlığı ve tekrarlayan konvülziyonlar gelişiyor. Fizik muayenesinde akciğerlerinde bilateral alt zonlarda krepitan raller işitiliyor.
Laboratuar tetkiklerinde ise:
Sodyum: 136 mEq/L (135-145mEq/L)
Potasyum: 2.2 mEq/L (3.5-5.0 mEq/L)
Klor: 93 mEq/L (95-105 mEq/L)
Bikarbonat: 28 mEq/L (22-28 mEq/L)
BUN: 15 mg/dl (7-18 mg/dl)
Kreatinin: 0.7 mg/dl (0.6-1.2 mg/dl)
Kalsiyum: 7.8 mg/dl (8.4-10.2)
Albumin:2.2 mg/dl (3.5-5.5 g/dl)
Glukoz:90 mg/dl (70-100 mg/dl)
Magnezyum:0.9 mg/dl (1.5-2.0 mg/dl)
Fosfor:1.2 mg/dl (3.0-4.5 mg/dl)
Aşağıda verilen hormonlardan hangisinin düzeylerindeki hızlı artış hastanın mevcut kliniğini en iyi açıklar?
A. Triiyodotironin
B. İnsülin*******
C. Glukagon
D. Aldosteron
E. Kortizol
CEVAP:B
Kronik açlık sonrası akut beslenme anoreksia nervozalı hastalarda hayatı tehdit eden bir durumdur. Refeeding sendromunda ortaya çıkan bulgular insülin düzeylerinde hızlı yükselme ve buna sekonder gelişen akut anabolizma ile ilişkilidir. Karbonhidrat alımı, oral veya parenteral, pankreatik insülin salınımına neden olur. İnsülin sekresyonu ile birlikte potasyum, magnezyum ve fosfor hücre içine alınır. Fosfor düzeylerinin azalması ile birlikte ATP üretimi sınırlanır, özellikle potasyum ve magnezyum düzeylerindeki azalma ise kardiyak artimilerin ortaya çıkmasına neden olur. Tiamin eksikliği ise periferik vazodilatasyon ile birlikte renin anjiotensin aldosteron sisteminin aktivasyonuna ve su-tuz tutulumuna neden olur. Kronik açlığın neden olduğu kardiyak atrofi zemininde yeni gelişen overvolemi kalp yetmezliğinin gelişmesine sebep olmaktadır.
A. Anoreksia nervozalı hastalarda hasta ötiroid sendromu görülür. Normal TSH düzeyleri ile birlikte düşük veya normal düzeyde tiroksin ve triiodotironin düzeyleri beklenir.
C. Glukagon aktivitesi kronik açlıkta artarken beslenme ile birlikte baskılanmaktadır.
D. ve E. Aldosteron ve kortizol, su-tuz tutulumu ve potasyum atılımına neden olur, bu sayede kan basıncını temin ederler. Bu hormonların düzeyleri açlıkta yüksek seviyelerde iken beslenme ile birlikte azalır.
Refeeding sendromu, kronik açlık sonrası beslenme rehabilitasyonunun ölümcül bir komplikasyonudur. Beslenme ile indüklenen insülin düzeylerinde artış; potasyum, magnezyum ve fosforun hücre içine geçişine neden olur. Klinik bulguları aritmiler ve kalp yetmezliği şeklinde ortaya çıkar.